ARTHROSAMİD® (İPAAG) BİLİMİ
Diz osteoartriti olan yetişkinler için yeni bir tedavi
Arthrosamid® emilemeyen, biyobozunmayan, enjekte edilebilen, şeffaf, hidrofilik bir jel olup sıkıca bağlanmış, biyobozunmayan poliakrilamid (%2,5) ve bağlı pirojenik olmayan su (%97,5) içeren bir omurgadan oluşur
Arthrosamid® önceden doldurulmuş, tek kullanımlık, steril, 1 mL şırınga olarak bir luer lock bağlantısı ve bir uç kapağıyla kapatılmış olarak tedarik edilir. Steril bir 21G x 2 inç (0,8 x 50 mm) iğneyle diz eklemine eklem içi olarak enjekte edilmesi amaçlanmıştır.
POLİAKRİLAMİDİN KİMYASAL TANIMI
Yukarıda açıklandığı gibi Arthrosamid®Hidrojel, %2,5 kuru maddeli çapraz bağlı poliakrilamid ve %97,5 pirojenik olmayan sudan oluşur. Sentez sırasında N,N, Metilen-bis-akrilamid, akrilamid ile polimerize olarak poliakrilamid zincirleri arasında çapraz bağlar oluşturur.
Çapraz bağlı poliakrilamid hidrojel, tekrar eden akrilamid birimlerinin zincirleme bir reaksiyonla bağlandığı bir polimerizasyon işleminde sentezlenir.
Zincirleme reaksiyon, bir amonyum persülfat (AMPS) başlatıcısının, akrilamiddeki çift bağdan bir elektron elde ederek bir akrilamid monomeri ekleyen ve böylece akrilamid ile tek bir karbon-karbon bağı oluşturan bir serbest radikal ürettiği bir redoks başlatıcı prensibini içerir. Bu, Şekil 2'de sağda gösterildiği gibi akrilamid monomerlerinin daha fazla eklenmesi için paylaşılmamış bir elektron bırakır.
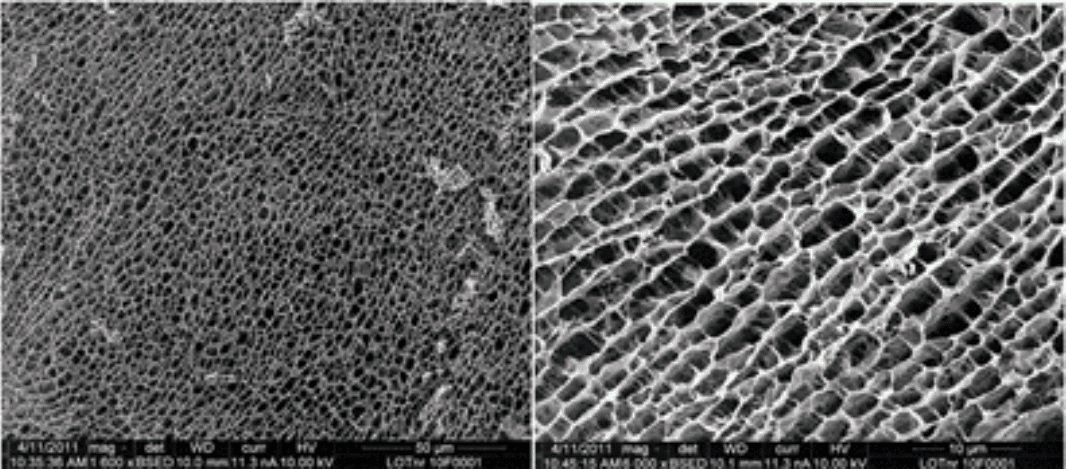
Poliakrilamidin doğrusal karbon-karbon omurgasının dallanması, Şekil 3'te gösterildiği gibi bir çapraz bağlama maddesi olan N,N-metilen-bis-akrilamid monomerinin (MBAM) varlığı nedeniyle meydana gelecektir.
Omurga poliakrilamid zincirlerinin dallanmasından sonra bağlantısız doğrusal poliakrilamid zincirleri yerine üç boyutlu çapraz bağlı bir poliakrilamid ağı oluşur.
ARTHROSAMİD® MALZEMELERİ VE BİYOUYUMLULUĞU
Arthrosamid® tıbbi bir madde, doku veya kan ürünleri içermez.
Arthrosamid® içinde kullanılan malzemeler aşağıda listelenmiştir (Tablo 2).
|
Cihaz parçası |
Malzeme |
Vücut teması |
|
|---|---|---|---|
|
Jel |
Yaklaşık %2,5 çapraz bağlı poliakrilamid ve %97,5 pirojenik olmayan sudan oluşan hidrofilik jel |
Diz eklemi |
|
|
Şırınga |
hazne |
Polipropilen |
Deri* |
|
piston |
Polikarbonat |
Deri* |
|
|
kauçuk tıpa |
Silikon kauçuk |
Deri* |
|
|
kaydırıcı |
Silikon yağı |
Deri* |
|
|
uç kapağı |
Polipropilen |
Deri* |
|
Tablo 2. Cihaz malzemeleri. *Şırınga, koruyucu eldiven giymesi gereken ilgili kullanıcı tarafından kullanılır. Bu nedenle normalde ne hasta ne de ilgili kullanıcı şırıngayla temas etmemelidir. Kauçuk tıpa ve kaydırıcı madde açıkta değildir ve bu nedenle bunlarla temas etme riski açıkta olan şırınga parçalarına göre daha da düşüktür.
Contura'nın mevcut hidrojel ürünleri için ISO 10993-1 uyarınca biyouyumluluk testleri gerçekleştirilmiş, Arthrosamid® ile ilgili olduğu düşünülen testler aşağıda özetlenmiş (Tablo 3) ve Biyolojik Değerlendirme Raporu'nda (BER) - Arthrosamid® ayrıntılı olarak açıklanmıştır.
|
Biyolojik değerlendirmenin bitiş noktası |
Standart referans |
Test ve test numarası |
Rapor Tarihi |
Sonuç |
|---|---|---|---|---|
|
sitotoksisite |
ISO 10993-5:2009 29 ABD Doları |
Hidrojel B: İn Vitro Sitotoksisite Testi 16/368-030C |
2017 |
Geçti |
|
Duyarlanma |
ISO 10993-10:2010 |
Denekte Temas Aşırı Duyarlılığının Değerlendirilmesi (Maksimizasyon-Testi) Farelerde Lokal Lenf Nodu Deneyi 517557 No'lu |
2017 |
Geçti |
|
Hidrojel B: Lokal Lenf Nodu Deneyi (Cilt hassasiyeti) No.77691) |
2017 |
|||
|
Tahriş veya intrakutanöz reaktivite |
ISO 10993-10:2010 |
Tavşanda İntrakutanöz Reaktivite Testi 77693 No. |
2017 |
Geçti |
|
Sistemik toksisite (akut) |
ISO 10993-11: 2017 / 10993-12: 2012 USP 151 |
Malzeme Aracılı Pirojenite Testi Hayır. APS-GZJ009-ST01 |
2018 |
Geçti |
|
Subkronik toksisite (subakut toksisite) |
ISO 10993-6:2007 |
Koyunlarda İki Yıllık İmplantasyon Çalışmasında subkronik toksisite için sistemik toksisite son noktaları incelenmiştir 285465 No. |
2017 |
Geçti |
|
Genotoksisite |
ISO 10993-3: 2014 |
Bakteriyel Ters Mutasyon Deneyi (Ames testi) 16/368-007M |
2017 |
Geçti |
|
In vitro memeli Kromozomal Aberasyon testi 16/368-020C |
2017 |
|||
|
In vivoMemeli Eritrosit Mikronükleus Testi 16/368-013E |
2017 Nisan07 |
|||
|
İmplantasyon |
ISO 10993-6:2007 |
Koyunlarda İki Yıllık İmplantasyon Çalışması 285465 No. |
2017 |
Geçti |
Tablo 3. Contura'nın hidrojeli üzerinde gerçekleştirilen biyouyumluluk çalışmaları (ve implantasyon çalışması)
Yapılan testlere dayanarak Arthrosamid® biyouyumlu ve vücutla uzun süreli temas için uygun olarak kabul edilir.
ARTHROSAMİD®'İN STABİLİTESİ VE KULLANIM ÖMRÜ
Contura'nın poliakrilamid hidrojellerinin stabilitesi, Biyolojik Değerlendirme Raporu (BER) - Arthrosamid®'de kapsamlı bir şekilde açıklanmış ve tartışılmıştır ve de "Hidrojel B" üzerindeki potansiyel hidroliz, oksidatif ve fiziksel stresi araştıran stabilite testlerinin bir özeti aşağıda verilmiştir (Tablo 5). BER'de incelendiği üzere poliakrilamidin enzimatik bozunması çeşitli enzimatik fermantasyon sistemlerinde test edilmiş ancak herhangi bir bozunma gözlenmemiştir.
| Durum | Ölçek | Sonuç | Test Referansı |
|---|---|---|---|
| Hidroliz ve oksidatif stres | Çift Hidrojel B numuneleri 370C'de 24 saat oksidatif olmayan, orta oksidatif ve aşırı oksidatif hipotonik ve izotonik çözücülerde inkübe edilmiştir. pH 2 ayarlı ve ayarlanmamış nötr çözücüler karşılaştırılmıştır. Örnekler HPLC ile analiz edilmiştir. |
Hidrojel B, oksidatif olmayan ve oksidatif ve agresif hidrolitik asidik test koşulları altında herhangi bir monomerik akrilamid oluşturma eğilimi göstermemiştir. |
ChemPilot 2018 |
| Fiziksel stres |
Deneysel bir düzenek, hidrojeli bir bıçak karıştırma prosedüründe aşırı mekanik kesme gerilimine maruz bırakmıştır. |
Aşırı mekanik stres, hidrojelin akrilamid monomerlerine bozunmasına yol açmamıştır. Bıçak karışımı gibi aşırı mekanik stres, fizyolojik koşullar sırasında yaşanmaz. |
Kontur (011.INR.00025) |
Tablo 5. Contura'nın hidrojeli ("Hidrojel B") üzerinde gerçekleştirilen stabilite çalışmaları.
Poliakrilamid hidrojelin stabil olduğu ve test koşulları altında bozulmadığı görülmektedir.
ARTHROSAMİD® STABİLİTESİ: MİGRASYON
Poliakrilamid hidrojelin migrasyon potansiyeli, BER'de ve "Arthrosamid®Migrasyon ve İntraartiküler Uygulama Sonrası Bozunma Potansiyelinin Değerlendirilmesi" raporunda incelendiği gibi kapsamlı bir şekilde incelenmiştir. Kısacası intraartiküler enjeksiyonla ilgili olarak küçük partiküllerin (8 µm veya daha az) fagositoza maruz kaldığı ve sinovyal epitelyumdaki boşluk bağlantılarından sinovyal sıvıyla birlikte akacağı ve sonunda sistemik olarak dağılacağı, daha büyük partiküllerin (> 8-17 µm) ise zamanla kapsüllendiği ve yumuşak dokular içinde süresiz olarak hareketsiz kaldığı gözlemlenmiştir. Daha önce açıklandığı gibi, Arthrosamid®/ "Hidrojel", poliakrilamid zincirlerinin çapraz bağlı bir matrisi olarak yapılır. Enjekte edilen son madde esasen küçük parçacık bileşenlerine sahip değildir ve ölçülebilen en küçük parçacık boyutu > 300 μm olarak ölçülmüştür. Bu da fizyolojik olarak hareketli olduğu bildirilen tek mikron parçacık boyutunun oldukça üzerindedir.
Tavşan ve atlar üzerinde yapılan çalışmalarda hidrojelle ilişkili makrofajlar ve dev hücreler gözlenmiş ve bu hücrelerde fagozomlar içinde hidrojel partiküllerine dair bir kanıt bulunmamıştır (Christensen vd., 2016). Drene lenf nodlarını ve yumuşak doku enjeksiyon bölgelerinden uzaktaki dokuları değerlendiren ve yerel drene lenf nodlarında veya uzak organlarda hidrojel kanıtı bulunmayan ek çalışmalar yapılmıştır (Charles River, 2011). Contura'nın poliakrilamid hidrojellerinin migrasyon potansiyeli, poliakrilamid hidrojelin subsinovyal dokularda kalıcı bir implant olarak kalacağı sonucuna, yayınlanmış yayınlara ve Arthrosamid® spesifik testlere dayanarak, BER'de kapsamlı bir şekilde açıklanmış ve tartışılmıştır.
ARTHROSAMİD®: İPAAG'NİN KLİNİK VE KLİNİK ÖNCESİ BULGULARI
Tavşanlarda ve atlarda hidrojelin entegrasyonu, enjeksiyondan sonra 2 yıla kadar takip edilmiştir. Tedaviden 2 hafta sonra atlarda hidrojel, tavşan modelinde görülen histolojiye benzer şekilde çoğalan sinovyal hücrelerle karışmış sinovyal astar içinde bir iç tabaka olarak ortaya çıkmıştır. 1. ayda sinovyal hücreler görünüşe göre yüzeye doğru yer değiştirmiş ve 3, 8 ve 24. aylarda benzer bir entegrasyon modeli gözlenmiştir (Christensen vd., 2016). Hidrojel, ince bir damar taşıyan doku ağı ve çok az sayıda enflamatuar hücreyle subsinovyal interstisyum içinde entegre bir bölge olarak bulunmaktaydı.
Total diz artroplastisi (TDA) sırasında hastalardan alınan dokular üzerinde ileriye dönük bir histopatolojik çalışma gerçekleştirilmiştir. Hastalar 5-33 ay önce hidrojelle tedavi görmüştür. Yedi vakanın tümünde benzer bir histolojik örüntü görülmüştür: Hidrojelin sinovyal zara entegre olduğu ve dış sinovyal astar hücrelerinin jelin içine girerek de novo astar tabakası oluşturduğu tespit edilmiştir. Bir vaka çalışmasında TDA'dan 9 ay sonra benzer bir örüntü tanımlanmıştır (Christensen ve Daugaard, 2016).
Contura'nın hidrojelleri 2001 yılından beri piyasada bulunmaktadır ve çeşitli endikasyonlar için değişen takip sürelerine sahip bir dizi klinik çalışma yürütülmüştür. Contura poliakrilamid hidrojelle ilgili uzun vadeli veriler, yüz lipotrofisinin tedavisi için ortalama 6 ml Aquamid®hidrojel enjekte edilen 104 HIV hastasını içeren 10 yıllık bir takip çalışmasından elde edilmiştir. Takip sürecinde (10 yıl) hiçbir hastada hidrojel migrasyonu görülmemiştir ve hastaların çoğunluğu kozmetik sonuçtan "oldukça memnun" (%74,8) veya "memnun" (%23,4) olduğunu belirtmiştir (Negredo vd., 2015). Bulkamid® hidrojelle tedavi edilen stres üriner inkontinanslı 25 kadının sekiz yıllık takip çalışmasında da hidrojelin stabil görüntüsü gözlemlenmiş ve tüm hastaların vajinal ultrasonografide görünür poliakrilamid hidrojel birikintilerine sahip olduğu görülmüştür (Mouritsen vd., 2014).
SONUÇ: ARTHROSAMİD®'İN STABİLİTESİ VE KULLANIM ÖMRÜ
Bu ve önceki bölümlerde açıklandığı üzere klinik öncesi çalışmalar Arthrosamid®/ "Hidrojel "in biyouyumlu, emilmeyen, biyobozunmayan ve göç etmeyen bir ürün olduğunu göstermiştir (Bello vd., 2007; Charles River, 2011; Zarini vd., 2004). Uzun vadeli klinik veriler bunu doğrulamıştır (Mouritsen vd., 2014; Negredo vd., 2015). Bu nedenle Arthrosamid®'in cihazın kullanım ömrü boyunca stabil ve güvenli olduğu sonucuna varmak makul olmaktadır.
Arthrosamid®'in kullanım amacı aşağıda özetlenmiştir:
|
Arthrosamid®'in kullanım amacı |
|
|
Endikasyon |
Arthrosamid®, yetişkinlerde diz osteoartritinin semptomatik tedavisi için kullanılmak üzere tasarlanmıştır. |
|
Tedavi edilmesi planlanan hastalık |
Osteoartrit diyor. |
|
Hasta popülasyonu |
Osteoartrit tanısı konmuş yetişkin hastalar. |
|
Amaçlanan uygulama |
Arthrosamid®, diz eklemine intra-artiküler olarak enjekte edilmek üzere tasarlanmıştır. |
|
Hedeflenen kullanıcı |
Arthrosamid®, ortopedik cerrahlar veya romatologlar gibi eklem içi enjeksiyon prosedürlerine aşina nitelikli doktor tarafından kullanılmak üzere tasarlanmıştır. |
|
İnsan vücudu üzerindeki etkisi |
Arthrosamid®, osteoartritten etkilenen dizde ağrıyı azaltır ve fonksiyonu iyileştirir. |
|
Cihazın temas eden dokular |
Diz eklemi. |
|
Kullanım süresi |
Uzun vadeli (>30 gün)*. |
|
Mukozal zarlarla temas |
Arthrosamid® diz ekleminin sinovyal zarıyla temas halindedir. |
|
İnvaziv / invaziv olmayan |
İnvaziv. |
|
İmplante edilebilir / implante edilemez |
İmplante edilebilir. |
|
Tek kullanımlık/tekrar kullanılabilir |
Tek kullanımlık. |
|
Önerilen doz |
6 ml**. |
|
Kontrendikasyonlar |
Arthrosamid® ilgili durumlarda enjekte edilmemelidir:
|
|
Uyarılar |
|
|
Üretici tarafından gerekli görülen önlemler |
|
Tablo 6. Arthrosamid®'in kullanım amacı. *Arthrosamid® için on iki aylık klinik takip verileri sunulmuş olup (bkz. 5.4.1 ve 5.4.4), Contura'nın diğer endikasyonlara yönelik hidrojelleri için 8 veya 10 yıla kadar uzun vadeli klinik veriler mevcuttur (3.1.2.10) ve bu nedenle kalıcı implant/hidrojelin, cihazın kullanım ömrü boyunca stabil ve güvenli olduğuna inanılması makuldür (3.1.2.10).
**Önerilen 6 ml'lik dozaj, "kavram kanıtlama" çalışmasında enjekte edilen toplam jel hacmine [hastaların çoğunluğu (%96) için 2 x 3 ml] ve CON-OA çalışmasından elde edilen verilere dayanmaktadır (5.4.4). 2 x 3 ml'ye kıyasla 6 ml'lik tek bir enjeksiyon, enfeksiyon riskini azaltır ve profilaktik antibiyotik kullanımı sadece bir kez yapılır.
